
Fil d'Ariane
- Nouvelles et événements
- Nouvelles
- Content
- Des scientifiques de L’Institut participent à une étude internationale sur la synthèse de l’ADN
null Des scientifiques de L’Institut participent à une étude internationale sur la synthèse de l’ADN
Les résultats, publiés dans Science, révèlent comment une protéine unique aide des cellules à déterminer à quel moment produire les éléments constitutifs de l'ADN — une découverte aux implications possibles pour le cancer et certaines maladies métaboliques héréditaires
SOURCE : CeMM Research Center for Molecular Medicine, Austrian Academy of Sciences
Le 7 novembre 2025
À l'intérieur de chaque cellule, un réseau métabolique bien ajusté détermine à quel moment constituer, recycler ou cesser de produire des molécules essentielles. Un élément au cœur de ce réseau est le métabolisme du folate, qui fournit les unités chimiques nécessaires à la synthèse de l'ADN, de l'ARN et des acides aminés. Lorsque ce système est perturbé – en raison de mutations génétiques ou d'une absence de folate alimentaire - les conséquences peuvent aller des troubles du développement jusqu'au cancer.
Des chercheuses et des chercheurs du CeMM, le Research Center for Molecular Medicine of the Austrian Academy of Sciences (centre de recherche en médecine moléculaire de l'Académie autrichienne des sciences), en collaboration avec des scientifiques de l'University of Oxford et des contributeurs de L'Institut de recherche du Centre universitaire de santé McGill (L'Institut), ont maintenant identifié un acteur inattendu dans l'équilibre métabolique : l'enzyme NUDT5. Les résultats de l'étude, publiés dans Science, démontrent que l'enzyme NUDT5 contribue à l'arrêt de la production de purine — la voie qui génère les bases de l'ADN — mais qui le fait sans avoir recours à son activité enzymatique. Au lieu de cela, la protéine agit comme une charpente moléculaire qui freine physiquement une étape clé de la biosynthèse lorsque les niveaux de purine sont déjà élevés.
« Nous sommes ravis de jouer un rôle dans les travaux importants dont il est ici question, en proposant des cellules cultivées à partir de cellules provenant de patientes et de patients présentant des mutations du gène MTHFD1 », a déclaré David Rosenblatt, M.D., l'un des coauteurs de l'étude et scientifique au sein du Programme en santé de l'enfant et en développement humain (programme SEDH) à L'Institut. Des cellules provenant de patientes et de patients atteints d'une maladie génétique, que nous avons initialement décrite en 2011, ont joué un rôle crucial pour ce qui est de démontrer que l'adénosine peut aussi être toxique, selon la nature exacte de la mutation du gène MTHFD1. »
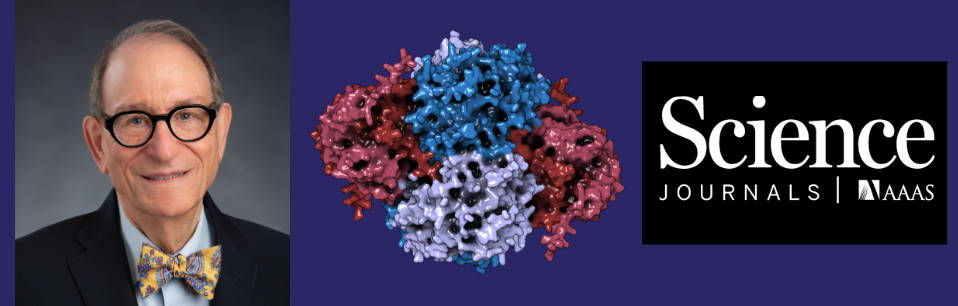
Nouveau rôle pour une vieille enzyme
Les purines sont des molécules essentielles que les cellules utilisent pour constituer l'ADN et l'ARN ainsi que pour emmagasiner de l'énergie. Elles peuvent être recyclées à partir de molécules existantes ou être produites en partant de zéro, en empruntant une soi-disant voie de novo – processus très énergivore devant être étroitement contrôlé.
Dans leur étude, les chercheuses et les chercheurs ont exploré le mécanisme de contrôle auquel il est fait référence ci-dessus, en étudiant les cellules présentant des mutations du gène MTHFD1, enzyme jouant un rôle crucial dans le cycle du folate. Le métabolisme du folate fournit les unités à un carbone nécessaires à la synthèse des purines ; des irrégularités dans cette voie causent des maladies génétiques rares et influent sur le risque de cancer.
Ayant recours à une combinaison de dépistage génétique, de métabolomique et de chimie biologique, l'équipe a découvert que la protéine NUDT5 interagit avec une autre enzyme, l'enzyme PPAT (acronyme de phosphoribosyl pyrophosphate amidotransferase), qui catalyse la première étape de la synthèse de la purine. Lorsque les niveaux de purine augmentent, l'enzyme NUDT5 se fixe à l'enzyme PPAT et la rend vraisemblablement inactive – ordonnant en fait à la cellule de cesser de produire des purines supplémentaires.
Étonnamment, cette fonction de l'enzyme NUDT5 ne dépend pas uniquement de son activité enzymatique connue, qui hydrolyse les dérivés des nucléotides. Même lorsque son cycle catalytique était bloqué sur le plan chimique ou désactivé sur le plan génétique, la protéine a poursuivi la régulation de la synthèse de la purine. Les cellules n'ont perdu ce mécanisme de contrôle que lorsque l'enzyme NUDT5 a été complètement supprimée – soit par neutralisation génétique soit par le développement d'une nouvelle molécule qui la dégrade de manière sélective.
Contrôle métabolique aux implications médicales
La découverte permet de mieux comprendre comment les cellules perçoivent et réagissent aux changements dans leur environnement métabolique. « L'enzyme NUDT5 a longtemps été considérée comme une enzyme qui hydrolyse les dérivés des nucléotides, » poursuit Stefan Kubicek, chercheur principal au CeMM et auteur principal de l'étude. « Toutefois, nos travaux révèlent l'existence d'un rôle complètement différent – l'enzyme NUDT5 agit comme régulateur structurel qui détermine si la cellule continue ou non à produire des purines. »
Le mécanisme susmentionné peut aussi expliquer pourquoi certaines cellules deviennent résistantes à certains médicaments utilisés en oncologie. « Bon nombre de traitements de chimiothérapie, comme la 6-thioguanine, agissent en imitant les molécules de purine et en bloquant la synthèse de l'ADN », ajoute Tuan-Anh Nguyen, copremier auteur de l'étude. Toutefois, nous avons conclu que les cellules dépourvues d'interaction fonctionnelle entre les enzymes NUDT5 et PPAT étaient moins sensibles à ces traitements, ce qui laisse entendre que les mutations de l'enzyme NUDT5 pourraient contribuer à la pharmacorésistance des tumeurs. » Des conclusions similaires, tirées par le laboratoire de Ralph DeBerardinis, aussi publiées dans le même numéro de Science, soutiennent le rôle clé de la NUDT5 quant au contrôle de la sensibilité aux médicaments anticancer.
« Nos conclusions font ressortir le fait que les enzymes peuvent non seulement agir par l'intermédiaire des réactions chimiques qu'elles catalysent, mais aussi grâce à leur structure, » conclut Stefan Kubicek. « Parfois, c'est la présence physique d'une protéine qui fait la différence cruciale. »
À propos de l'étude
Les auteures et les auteurs de l'article intitulé « A non-enzymatic role of Nudix hydrolase 5 in repressing purine de novo synthesis » sont Tuan-Anh Nguyen, Jung-Ming G. Lin, Anne-Sophie M. C. Marques, Maximilian Fottner, Ludwig G. Bauer, Andreas Reicher, Diana Daum, Lorenzo Scrofani, Yusi Liu, Carol Cheng, Luna D'Angelo, Juan Sanchez, Christoph Bueschl, Nara Marella, Pisanu Buphamalai, Florian Traversi, Maša Bereš, Herwig P. Moll, Marton Siklos, Jakob-Wendelin Genger, Gerald Hofstaetter, Ludovica Villanti, Monika Malik, Christoph Klimek, Kathrin Runggatscher, Bettina Guertl, Jesper S. Hansen, Sarah Dobner, Olga Babosova, Tina Becirovic, Laura P. M. H. de Rooij, Emilio Casanova, Anna Koren, D. Sean Froese, David S. Rosenblatt, Kristaps Klavins, Andreas Bergthaler, Jörg Menche, J. Thomas Hannich, Miriam Abele, Sara Sdelci, Kathrin Lang, Kilian V. M. Huber et Stefan Kubicek. Cet article a été publié dans Science le 6 novembre 2025.
Système DOI : 10.1126/science.adv4257
Les travaux du Dr Rosenblatt, réalisés à L'Institut, ont bénéficié du soutien du laboratoire Hess B. et Diane Finestone en mémoire de Jacob et Jenny Finestone et des Instituts de recherche en santé du Canada.
Relations avec les médias
Wolfgang Däuble, chef des relations avec les médias, CeMM Research Center for Molecular Medicine of the Austrian Academy of Sciences, wdaeublePraesent id dolor porta, faucibus eros vel@cemm.at
Fabienne Landry, relations avec les médias, L'Institut, FabiennePraesent id dolor porta, faucibus eros vel.landry@muhc.mcgill.ca
Nouvelles connexes
Décrypter les maladies complexes liées à la vitamine B12
Le Dr David Rosenblatt honoré pour l'ensemble de sa carrière
Novel inborn error of folate metabolism: identification by exome capture and sequencing of mutations in the MTHFD1 gene in a single proband, Journal of Medical Genetics 2011;48:590-592.